2024年7月9日,华中科技大学同济医学院附属协和医院骨科杨操教授团队联合苏州大学功能纳米与软物质研究院文震教授团队在Nature子刊Nature Communications(2024年IF:14.7,中科院1区)发表了题为“Self-powered triboelectric-responsive microneedles with controllable release of optogenetically engineered extracellular vesicles for intervertebral disc degeneration repair”的研究论文,解析了椎间盘退变进展中髓核细胞衰老的关键分子机制,设计了精准化靶向性椎间盘修复的新策略。

椎间盘退变是多种脊柱退变性疾病的重要病理基础,给广大患者带来了巨大的痛苦和负担,然而目前尚缺乏有效的治疗方法,因此深入探索椎间盘退变的关键调控机制及构建有效的再生修复策略具有重大的临床意义和社会价值。武汉协和医院骨科杨操教授团队积极响应医工融合,奋力推进基础转化,联合苏州大学文震教授团队,研发了自驱动响应性微针装置,整合靶向性光遗传学定制化细胞外囊泡的可控释放,以重建衰老髓核细胞的功能稳态,促进椎间盘炎性退变的精准化修复。
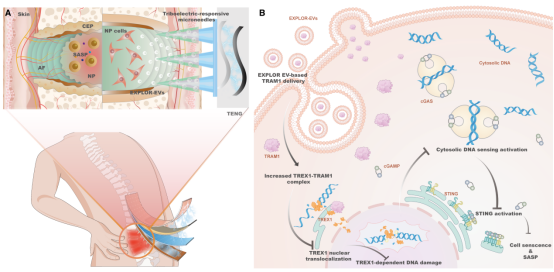
研究表明椎间盘退变伴随着DNA损伤及胞浆DNA感知相关通路活化。TREX1是介导胞浆损伤性DNA清除的核酸酶,然而其功能状态在退变的髓核细胞中仍不清楚。研究团队利用蛋白组学技术,鉴定了内质网相关蛋白TRAM1是调控TREX1清除功能的潜在伴侣分子。在退变髓核细胞中,TRAM1-TREX1蛋白复合物的解聚启动了TREX1向胞核转位,触发了TREX1核酸酶的活性,促进了TREX1由清除功能向损伤功能的转变,加速了胞浆DNA感知相关通路的活化,最终导致衰老髓核细胞炎性表型的转变及椎间盘退变。光遗传学工程化细胞外囊泡利用CRY-CIBN的光控结合效应,整合囊泡的生成及TRAM1蛋白的装载。自驱动响应性微针装置借助可穿戴式摩擦纳米发电机的摩擦电效应,将自身运动所产生的动能转变为电能,驱动负载TRAM1蛋白囊泡的释放,以重建退变髓核细胞内TREX1蛋白对于胞浆内损伤性DNA分子的清除功能,实现椎间盘退变修复的精准化、靶向化及响应性。

华中科技大学同济医学院附属协和医院骨科杨操教授、王丙金博士,苏州大学功能纳米与软物质研究院文震教授、孙旭辉教授为本文共同通讯作者,博士研究生张伟锋、秦璇、李高才及周星宇为本文共同第一作者。研究成果得到了国家自然科学基金项目、湖北自然科学基金项目以及智能纳米环保新材料及检测技术国际联合研究中心开放研究课题等多项课题项目的资助。
杨操教授团队在椎间盘退变机制和再生修复,以及组织工程领域开展了大量的研究工作。主持国家重点研发计划1项,国家自然科学基金重点项目1项,国家自然科学基金20余项。近年来在Nature Communications,Journal of Clinical Investigation,Science Advances,Materials Today,Advanced Materials,Autophagy,Cell death & differentiation,ACS Nano,Advanced Functional Materials,Advanced Science等国际著名期刊发表研究论文,多项研究成果获国家专利授权。