利用骨科内植入物固定或重建由于创伤或病变破坏的骨骼系统在临床上广泛应用。 目前临床上使用的骨科内植入物如人工假体或接骨板等普遍起力学支撑和固定作用,缺乏生物活性。随着3D打印技术在临床上逐步推广应用,利用3D打印技术在骨科内植入物表面打印生物活性材料,使传统的骨科内植入物兼具力学支撑和生物活性两方面的功能成为可能。近日,我院骨科杨操教授团队与天津大学吴水林教授、湖北大学刘想梅教授等团队合作在骨科生物活性材料研究方面取得重要进展,相关成果“A novel photothermally controlled multifunctional scaffold for clinical treatment of osteosarcoma and tissue regeneration”在线发表于材料领域国际顶级期刊《Materials Today》上(2018年影响因子24.372)。

骨肉瘤切除后的复发、大块骨缺损及周围软组织损伤是临床医生面临的重大挑战。目前传统的骨科生物活性材料虽然可以诱导手术部位骨再生,但并没有促进止血以及软组织修复的功能,也不能防止肿瘤细胞复发。本课题组基于前期对3D打印骨科内植入物的研究及界面活性改造的研究,设计了一种新型光热可控的复合材料,旨在消灭残余肿瘤的同时能够有效的促进组织的修复,为接下来对于3D打印的骨科内植入物的界面改性提供了有力的理论支持。
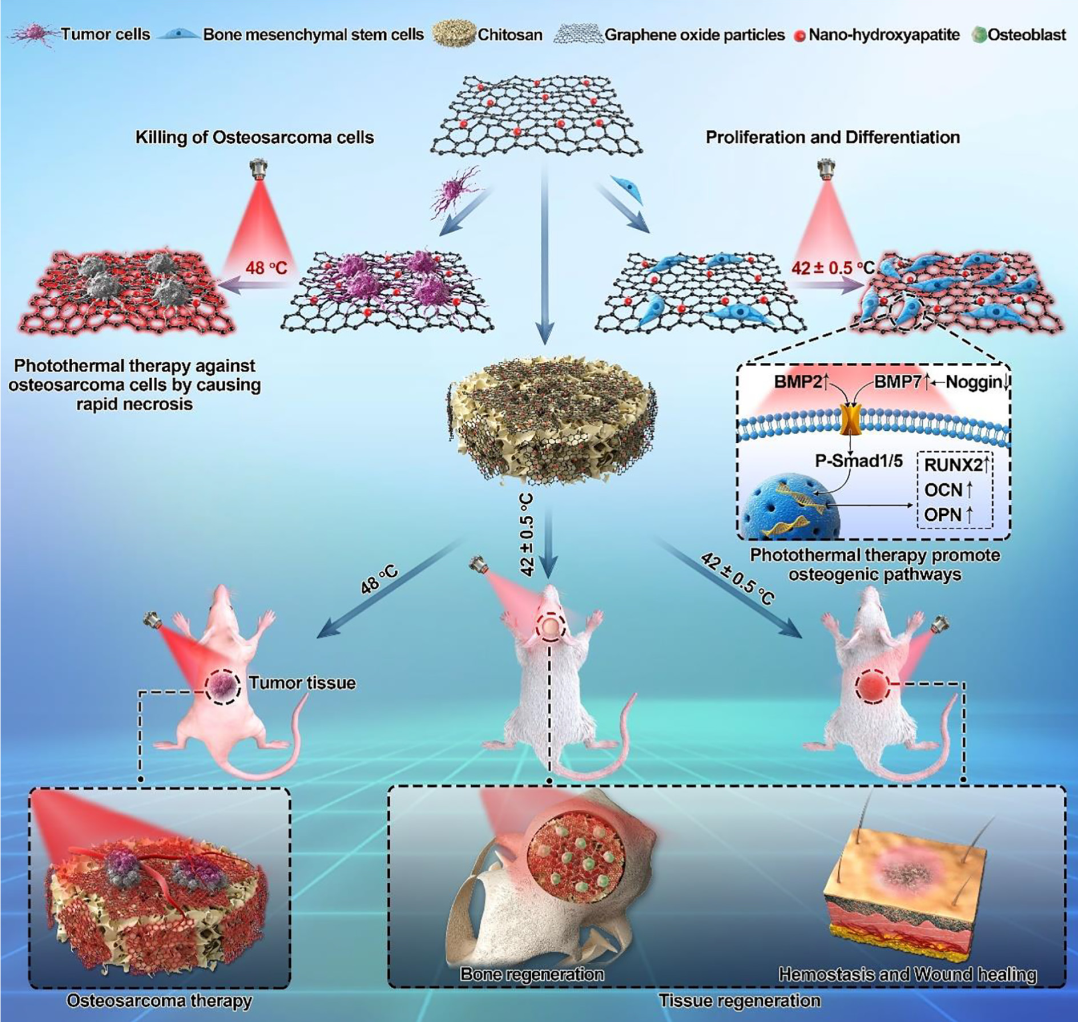
图1 新型多功能支架设计示意图
研究人员首先利用氧化石墨烯(GO)的光热效应及纳米羟基磷灰石(nHA)的骨诱导作用,首先研究了不同比例的nHA与GO复合粒子在808 nm近红外光照射前后对人骨肉瘤细胞(HOS)、前成骨细胞(MC3T3-E1)和人骨髓间充质干细胞(hBMSC)的影响。随后,以壳聚糖为载体制备了一种新型的光热可控的多功能纳米羟基磷灰石/氧化石墨烯/壳聚糖(nHA/GO/CS)支架,该支架通过光控可以在48 °C的近红外照射下有效地杀伤HOS,并在42 ± 0.5 °C的温度下促进细胞增殖及成骨分化。进一步的机制研究表明,nHA协同近红外光可能是通过增强BMP2/Smad信号通路来促进hBMSC的成骨。在动物实验中,该支架在大鼠颅骨缺损中植入8 周后具有良好的骨再生作用,同时可以促进创面修复。此外,该支架具有良好的止血效果,有利于照射下的周围软组织修复。该研究成果有效的结合了氧化石墨烯的光热作用以及纳米羟基磷灰石的促成骨作用,这一复合材料以及性质为本课题组下一阶段探究3D打印人工骨植入物的界面活性改性打下了夯实的基础。
杨操教授、吴水林教授和刘想梅教授为论文共同通讯作者,协和医院骨科医院马良硕士和冯晓波博士为论文共同第一作者,华中科技大学同济医学院附属协和医院为该研究第一单位。
本课题得到国家重点研发计划(2018YFB1105700)、国家自然科学基金(81772401, U1603121)等项目支持。此前,以我院为牵头承担单位,杨操教授担任首席科学家的“高性能聚合物材料个性化仿生内植入物增材制造技术及临床应用研究”项目获得国家重点研发计划资助,项目为期3年,总经费1260万元。该项目采用多学科交叉模式,形成高性能聚合物材料-增材制造-临床应用的研发团队。目前以该课题为支撑,已在《Materials Today》、《Nano Energy》、《ACS Appl Mater Interfaces》、《Theranostics》等国际高水平杂志发表相关论文。本课题为3D打印人工骨植入物材料的设计提供新策略,为实现植入物材料的多功能界面及促进组织修复具有重要推动作用。(骨科)
原文链接:https://www.sciencedirect.com/science/article/pii/S1369702119308788