2022年9月22日,我院陶凯雄教授团队联合美国梅奥诊所,在高水平期刊Nature Cancer (2022年首个IF:23.2)封面发表研究成果。华中科技大学同济医学院附属协和医院胃肠外科为第一单位,我院陶凯雄教授为共同通讯作者,曾祥宇博士为第一作者。

DNA双链断裂(DNA double-strand breaks, DSBs)是最具细胞毒性的DNA损伤形式。当DSBs发生后,细胞采用非同源末端连接(nonhomologous end-joining, NHEJ)和同源重组(homologous recombination, HR)两种方式进行修复。NHEJ修复是直接通过DNA连接酶将受损DNA末端连接在一起,这种简单、粗糙的修复方式可能导致某些碱基突变、序列缺失或片段插入的发生;相反,HR修复以同源姐妹染色单体为模版,精准进行识别、切割、重组,是一种高保真、无差错的修复方式。MRE11-RAD50-NBS1 (MRN)复合体是DSBs的感受器,此外,核酸酶MRE11可对DNA断裂末端进行切割以产生短链单链DNA,从而使得HR修复可以正常进行。DNA末端切割作为HR修复中的关键步骤,在细胞中受到众多分子的严格控制。
N6-甲基腺苷(m6A)甲基化是最常见的RNA修饰方式之一。METTL16是第二个被发现的m6A甲基转移酶,可特异性地催化具有UACAGAGAA序列的RNA。已有研究发现m6A修饰通过不同途径参与DNA损伤修复,但METTL16在DNA损伤修复中的功能尚无研究。
胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)俗称“癌症之王”,病人5年生存率不到10%。吉西他滨是PDAC最广泛应用的单药化疗药物,但其效果有限。探索其他靶向药物与吉西他滨联合应用是治疗PDAC的潜在策略。聚腺苷二磷酸⁃核糖聚合酶(PARP)抑制剂(PARPi)是首类基于合成致死概念开发合成的抗肿瘤药物。FDA已批准PARPi奥拉帕尼用于治疗种系BRCA1/2突变的转移性PDAC,但仅有7%-8%的PDAC病人伴随BRCA1/2突变,这使得大多数PDAC病人仍不能从PARPi中获益。另有研究表明,参与HR修复蛋白的异常表达使得细胞出现HR缺陷(HRD)状态也可表现为对PARPi敏感。因此,探寻PDAC中HRD标志物可拓展PARPi在PDAC中的临床应用范围,使更多的病人从中获益。
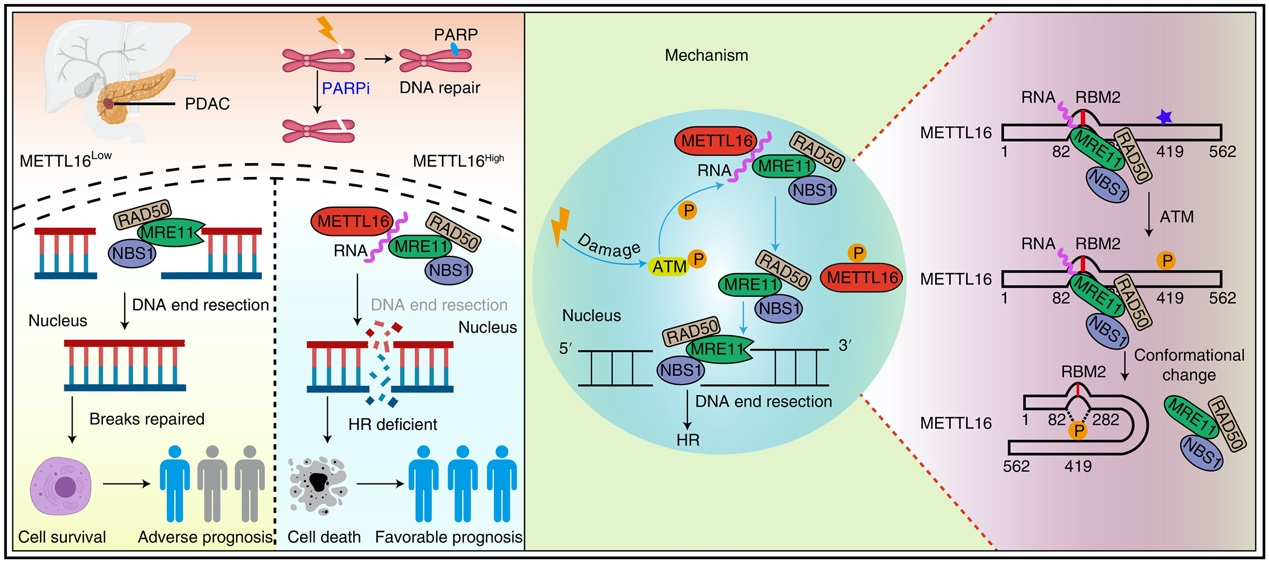
本研究中,首先发现PDAC组织芯片中METTL16表达与DNA损伤标志物g-H2AX成正相关性,提示METTL16在DNA损伤修复中的潜在作用,通过流式分析发现METTL16抑制HR修复。机制研究发现,METTL16受激酶ATM的调控,并且通过RNA依赖的方式与MRE11相互作用。DNA损伤发生后,ATM磷酸化METTL16中Ser419位点,导致METTL16蛋白发生构象改变降低其与RNA的亲和性,从而使得METTL16-RNA-MRE11复合体解离,游离的MRE11进行DNA末端切割从而促进HR修复的进行。因此,在细胞及动物实验中,METTL16高表达的PDAC可被PARPi选择性杀死,尤其是与吉西他滨联合使用时。
总体来说,该研究揭示了RNA和RNA甲基转移酶METTL16在DNA损伤修复中的作用,这代表的DNA末端切割新的调控方式。临床转化中,对于METTL16高表达的PDAC病人可潜在从PARPi单药或与吉西他滨联合使用中获益,这为PDAC的治疗提供了新的方向。
